Biochemie
Forschung über intrazelluläre Signaltransduktion und Biosensorik.
Proteinkinasen übertragen Phosphatgruppen auf Zielmoleküle (siehe 4.) und sind Schlüsselenzyme in der Signaltransduktion in Zellen, die an wichtigen menschlichen Krankheiten wie Krebs (Espiard et al JCI Insight 2018), neurodegenerativen Krankheiten wie Parkinson (Schmidt et al PNAS 2019, siehe 3.) sowie an menschlichen Krankheitserregern wie dem Malariaparasiten Plasmodium (Franz et al 2018: siehe 1.) beteiligt sind.
Untersuchung von Konformationsänderungen, die die Proteindynamik in Kinasen steuern (Immobilisierungsstrategien mit Ehresmann; Proteindynamik-Berechnungen und Markov-Zustandsmodellierung mit Garcia)
Proteinkinasen durchlaufen unterschiedliche Konformationszustände, und die Konformationskontrolle wurde als Konzept für die Kinase-Regulation etabliert. Wir untersuchen die zugrunde liegenden molekularen Mechanismen auf atomarer Ebene mit biophysikalischen Techniken sowie biochemischen Assays, unterstützt durch Proteindynamik-Berechnungen. Chemische Modifikationen von magnetischen Nanopartikeln (mnps) und von Biomolekülen werden zur Herstellung von mnp-Proteinkonjugaten verwendet, um Bindungsereignisse zu untersuchen und Konformationsänderungen zu quantifizieren. Dies wurde erfolgreich auf nanokristalline Diamant-Protein-Konjugate angewandt (Merker et al 2018). Eine neue Technologie, z.B. die switchSENSE-Technologie, wird etabliert, um Konformationsänderungen auf verschiedenen Skalen zu analysieren.
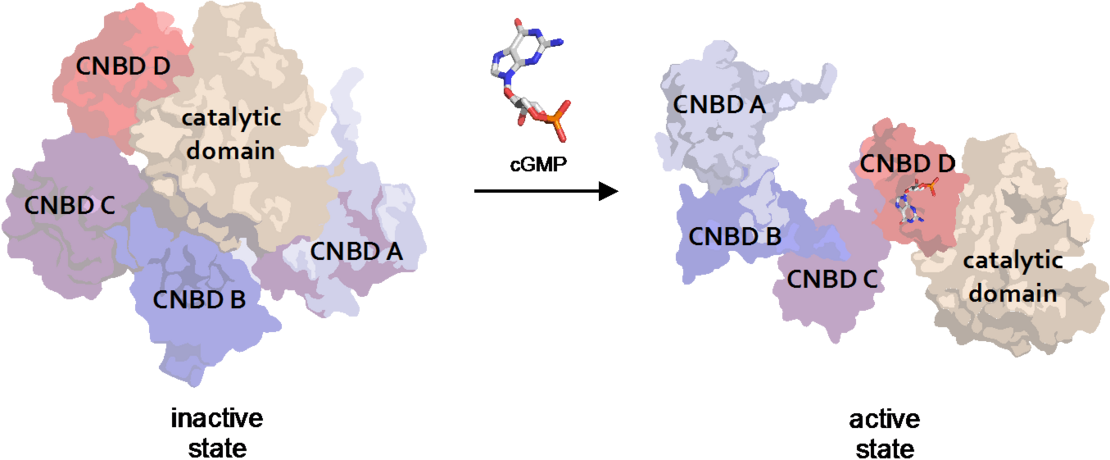
Abbildung 1. cGMP-abhängige Proteinkinase aus dem malariaverursachenden Parasiten Plasmodium falciparum (PfPKG, PDB 5DYK) erfährt bei der Bindung des Second Messengers cGMP ziemlich große Konformationsänderungen (nm-Bereich) (Franz et al 2018)
Referenzen:
Merker D et al. Nanostructured modified ultrananocrystalline diamond surfaces as immobilization support for lipases Diamond & Related Materials 90 (2018) 32–39
Franz E, Knape MJ, Herberg FW. cGMP binding domain D mediates a unique activation mechanism in Plasmodium falciparum PKG. ACS Infect Dis. 2018 Mar 9;4(3):415-423.
Erste Beschreibung eines Proteinmotivs, das die Kinasefunktion und -stabilität kontrolliert (in Zusammenarbeit mit U. California San Diego und dem National Center for Microscopy and Imaging Research, San Diego)
Die Leucin-reiche Wiederholungskinase 2 (LRRK2) ist ein großes Multidomänen-Protein, das mit der Parkinson-Krankheit in Verbindung steht. Die Regulation dieser Proteinkinase und die zugrundeliegenden pathogenen Mechanismen sind jedoch schwer fassbar. Zwei der fünf häufigsten familiären LRRK2-Mutationen (G2019S und I2020T) sind auf das konservierte DFG-Motiv (jeder hydrophobe Rest) im Kinasekern lokalisiert. Wir entdeckten einen wichtigen Regulationsmechanismus, der in die Kinasedomäne eingebettet ist, die für den Zusammenbau des regulatorischen Kinase-Rückgrats (RS) entscheidend ist, und zeigen, dass das DFG-Motiv als Konformationsschalter dient, der die LRRK2-Aktivierung antreibt.
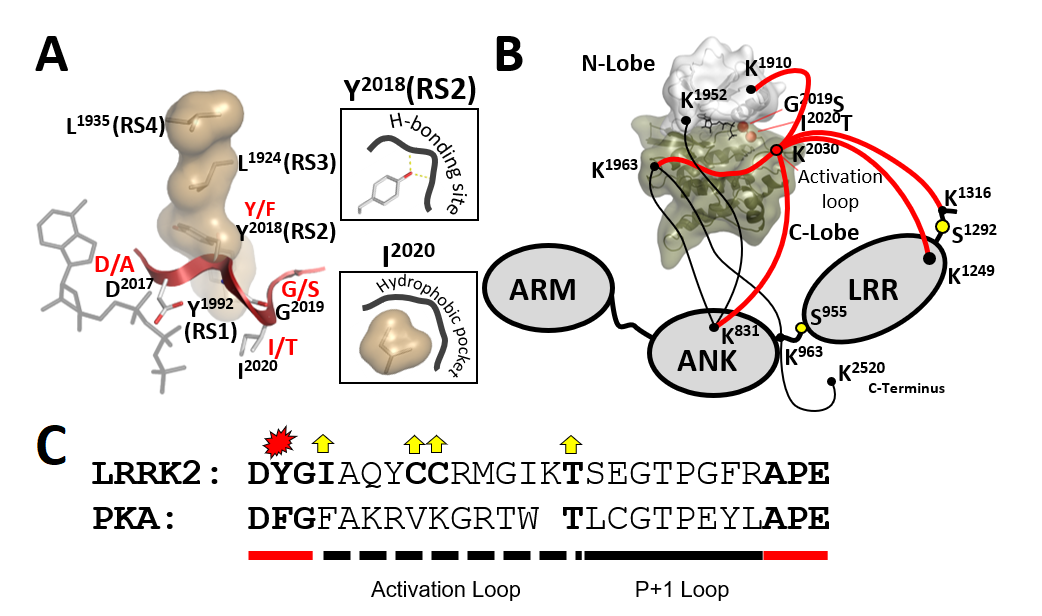
Abbildung 2. Der Zusammenbau der R-Wirbelsäule muss streng reguliert werden, um die Konformation des DYGψ Motivs und damit die ON- und OFF-Zustände der Kinase zu kontrollieren. Pathogene Mutationen in diesem Motiv (d.h. G2019S [DYGψ] und I2020T [DYGψ]) verändern die Kinase-Regulation und werden zu einer treibenden Kraft für die Parkinson-Krankheit. Mit Y2018F (RS2/ DYGψ) beschreiben wir eine Mutation, die den Merkmalen von G2019S und I2020T ähnelt.
Referenz:
Schmidt SH, Knape MJ, Boassa D, Mumdey N, Kornev AP, Ellisman MH, Taylor, SS and Herberg FW The dynamic switch mechanism that leads to activation of LRRK2 is embedded in the DFGψ motif in the kinase domain Proc Natl Acad Sci U S A 2019 Jul 23;116(30):14979-14988.
Untersuchung der Konformationsdynamik in der katalytischen Untereinheit (C) der Proteinkinase A (PKA-C).
PKA-C erfährt Konformationsänderungen im Subnanometerbereich. Wir verwendeten eine neuartige Methode, die auf der Oberflächenplasmonenresonanz basiert, um die Rolle des zweiwertigen Metallions bei der Konformationskontrolle von Proteinkinasen aufzuzeigen. Insbesondere das Kalzium, das für die Muskelkontraktion entscheidend ist, scheint eine wesentliche Rolle bei der Regulation der Proteinkinase zu spielen (Knape et al ACS Chem Biol. 2015, Knape et al Metallomics 2017, Zhang et al PLoS Biol. 2015).
Referenzen:
Knape MJ, Ballez M, Burghardt NC, Zimmermann B, Bertinetti D, Kornev AP and Herberg FW Divalent metal ions control activity and inhibition of protein kinases Metallomics 2017 Nov 15;9(11):1576-1584
Knape, MJ, Ahuja, LG, Bertinetti, D, Burghardt, NCG, Zimmermann, B, Taylor, SS, Herberg, FW Divalent metal ions Mg2+ and Ca2+ have distinct effects on protein kinase A activity and regulation ACS Chem Biol. 2015 Oct 16;10(10):2303-15
Zhang P, Knape MJ, Ahuja LG, Keshwani MM, King CC, Sastri M, *Herberg FW, *Taylor SS. (2015) Single Turnover Autophosphorylation Cycle of the PKA RIIβ Holoenzyme. PLoS Biol 13(7): e10021
9
Neues Forschungskonsortium zu Mechanismen von Kinasen und Phosphotransfer (PhosMOrg) finanziert durch das Programm "Zukunft" der Universität Kassel (Schaffrath, Herberg, Müller, Fuhrmann-Lieker, Garcia)
Die Modifikation von Proteinen durch Zugabe oder Entfernung von Phosphaten (Phosphorylierung/Dephosphorylierung) stellt für Zellen ein wichtiges Mittel zur Regulation von Prozessen dar. Phosphomodifikationen sind auch für die Synthese komplexer Biominerale von entscheidender Bedeutung. Die Phosphorylierung durch dedizierte Enzyme (Proteinkinasen) kann die Ladung oder Konformation des modifizierten Proteins verändern, wodurch sich schließlich seine biologische Aktivität ändert. Daher stellen Proteinkinasen molekulare 'An/Aus'-Schalter dar, die chemische Signale mit dem richtigen zellulären Verhalten orchestrieren (Abb.) PhosMOrg hat CINSaT-Mitglieder mit interdisziplinärer Expertise in Kinase-Biologie (Herberg, Müller, Schaffrath), Nanochemie (Fuhrmann-Lieker) und biomolekularer Modellierung (Garcia) zusammengebracht.
Prof. Dr. Friedrich W. Herberg
Ordentliches Mitglied

- Telefon
- +49 561 804-4511
- herberg[at]uni-kassel[dot]de
- Standort
- Universität Kassel
Fachbereich 10 - Naturwissenschaften & Mathematik
Institut für Biologie
Heinrich-Plett-Straße 40
34132 Kassel
- Raum
- 2161
