Metallorganische Chemie
A. R. Petrov, A. Derheim, J. Oetzel, M. Leibold, C. Bruhn, S. Scheerer, S. Oßwald, R. F. Winter, U. Siemeling, Inorg. Chem.2015, 54, 6657.
“A Stable Planar-chiral N-Heterocyclic Carbene with a 1,1´-Ferrocenediyl Backbone”
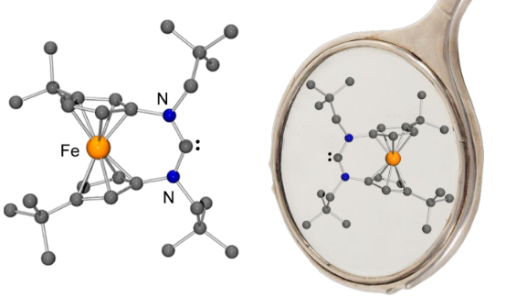
Ein stabiles N-heterozyklisches Carben mit einem redoxaktiven 3,3'-Di-tert-butylferrocenylen-Grundgerüst wurde synthetisiert und untersucht. Die tert-Butylgruppen verbessern signifikant die Löslichkeit des Carbens und seiner Vorläuferverbindungen in aprotischen organischen Lösungsmitteln. Darüber hinaus bewirken sie die planare Chiralität dieses Singulett-Carbens, dessen ausgeprägte Ambiphilizität es für die Aktivierung grundlegend wichtiger kleiner Moleküle wie CO geeignet macht.
F. Ahrend, U. Glebe, L. Árnadóttir, J. E. Baio, D. A. Fischer, C. Jaye, B. O. Leung, A. P. Hitchcock, T. Weidner, U. Siemeling, A. Ehresmann, Langmuir2016, 32, 10491.
“Magnetic field landscapes guiding the chemisorption of diamagnetic molecules”
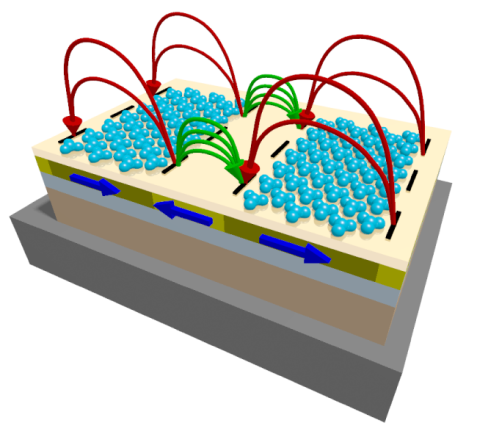
Die Selbstorganisation von Sub-Monolagen diamagnetischer Moleküle auf einer Oberfläche kann durch magnetische Streufeldlandschaften beeinflusst werden, die aus künstlich hergestellten magnetischen Domänen und Domänenwänden entstehen. Die gerichtete lokale Chemisorption diamagnetischer Moleküle in Bezug auf das künstlich erzeugte Domänenmuster wird durch eine Kombination von oberflächenanalytischen Methoden nachgewiesen: ToF-SIMS, X-PEEM und NEXAFS-Bildgebung.
M. Liebscher, C. Bruhn, U. Siemeling, J. Baio, H. Lu, T. Weidner, Eur. J. Inorg. Chem.2017, 351.
“The Interaction of 1,1’-Diphosphaferrocenes with Gold: Molecular Coordination Chemistry and Adsorption on Solid Substrates”
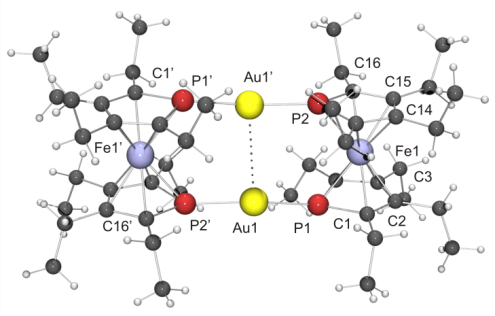
Das Bindungsverhalten von 1,1'-Diphosphaferrocenen gegenüber Gold wurde in der Molekular- und Oberflächenkoordinationschemie mit naturbelassenem 1,1'-Diphosphaferrocen und fünf Kongeneren mit bis zu acht Alkyl- oder Arylsubstituenten untersucht. Es werden selbstorganisierte Monolagen und molekulare AuI-Komplexe beschrieben, die beispiellose intermetallische Wechselwirkungen aufweisen.

L. Wallbaum, D. Weismann, D. Löber, C. Bruhn, P. Prochnow, J. E. Bandow, U. Siemeling, Chem. Eur. J.2019, 25, 1488.
“Stable and Persistent Acyclic Diaminocarbenes with Cycloalkyl Substituents and Their Transformation to b-Lactams by Uncatalysed Carbonylation with CO”
Azyklische Diaminocarbene (ADACs) sind ambiphill, was sie für die Aktivierung von grundlegend wichtigen kleinen Molekülen geeignet macht. Beispielsweise reagieren die meisten von ihnen mit CO unter milden Bedingungen. Leider geht eine derart hohe Reaktivität mit einer begrenzten thermischen Stabilität einher, was zu ihrer Zersetzung bei Raumtemperatur oder darunter führt. Der neue ADAC [(cyclo-C6H11)2N]2C ist in Lösung bis ca. 40 C stabil. Dennoch reagiert er leicht mit CO. Durch die Carbonylierung erhält ein -Lactam-Derivat mit nützlichen antibiotischen Eigenschaften.
R. Guthardt, J. Oetzel, J. I. Schweizer, C. Bruhn, R. Langer, M. Maurer, J. Vícha, P. Shestakova, M. C. Holthausen, U. Siemeling, Angew. Chem.2019, 131, 1401; Angew. Chem. Int. Ed.2019, 58, 1387.
“Reactive Dimerization of an N-heterocyclic Plumbylene: C-H Activation with PbII”
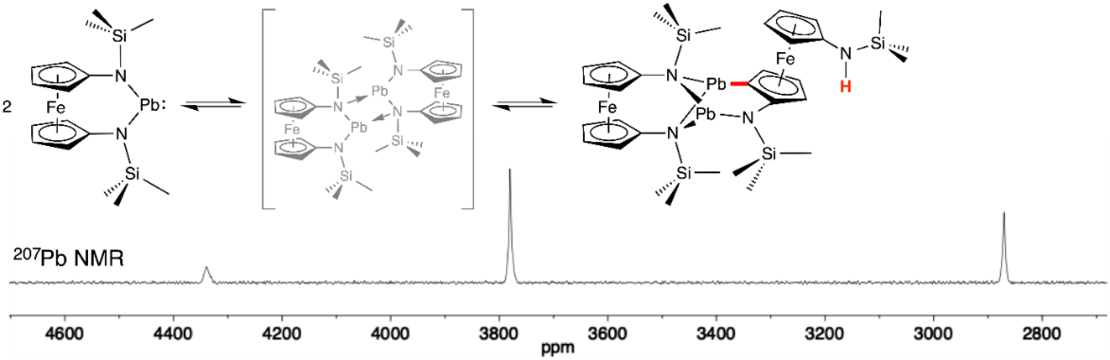
Eine noch nie dagewesene Art der Dimerisierung wird durch ein N-heterozyklisches Bleiplumbylen mit Ferrocenylen-Grundgerüst gezeigt. Das anfänglich gebildete aggregierte Dimer erfährt eine intramolekulare elektrophile Substitution durch einen Endo-Angriff eines PbII-Atoms, was zur Spaltung einer CH-Bindung und zur Bildung einer PbC- und einer NH-Bindung führt. Die Reaktion führt zu einem planar-chiralen Ferrocenderivat und ist das erste Beispiel einer CH-Aktivierung mit PbII.
Prof. Dr. Ulrich Siemeling
Ordentliches Mitglied

- Telefon
- +49 561 804-4576
- Fax
- +49 561 804-4777
- siemeling[at]uni-kassel[dot]de
- Standort
- Universität Kassel
Fachbereich 10 - Naturwissenschaften & Mathematik
Institut für Chemie
Heinrich-Plett-Straße 40
34132 Kassel
- Raum
- 2251
